Znajdujesz się na stronie wystawy: Medycyna. Ruch. Człowiek.
Materiały dostępne online stanowią cyfrową kontynuację ekspozycji, którą właśnie oglądasz.

Nasza wystawa to edukacyjno-inspiracyjny projekt, który pokazuje, że sport to nie tylko wysiłek, lecz świadomy wybór stylu życia – wspierany przez wiedzę i badania naukowe. W przystępny sposób przedstawia, jak codzienna aktywność fizyczna wpływa na zdrowie, samopoczucie i jakość życia.
Przeglądasz teraz sekcję Medycyna regeneracyjna – szybciej, skuteczniej, bezpieczniej, która przedstawia nowoczesne metody wspomagające regenerację organizmu, od komórek macierzystych i osocza bogatopłytkowego, po implantację chondrocytów i innowacyjne technologie, pozwalające szybciej wracać do pełnej sprawności.
Urazy i przeciążenia to codzienność życia sportowców – zarówno zawodowych, jak i amatorów. Jeszcze do niedawna poważna kontuzja mogła oznaczać długie miesiące rehabilitacji, ryzyko powikłań pooperacyjnych, a w najgorszym wypadku – koniec kariery. Dziś nowoczesna medycyna regeneracyjna daje sportowcom zupełnie nowe perspektywy – skrócenie czasu rekonwalescencji, uniknięcie operacji i trwałą poprawę funkcji uszkodzonych tkanek.
Poznaj najskuteczniejsze i sprawdzone metody terapii biologicznych, które zmieniają oblicze współczesnej medycyny sportowej.
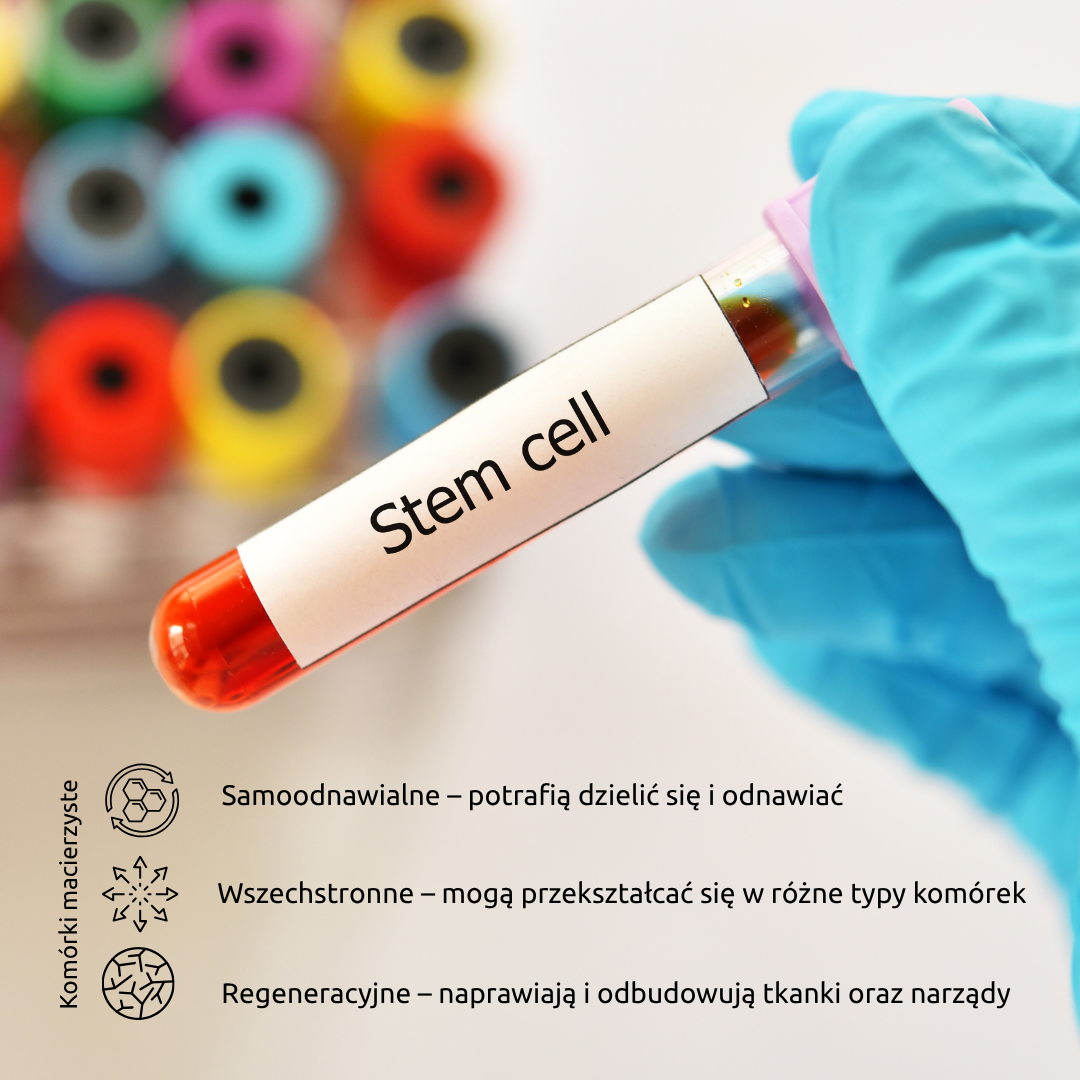
Komórki macierzyste (MSC) – inteligentna regeneracja tkanek
Mezenchymalne komórki macierzyste (Mesenchymal Stem Cells – MSC) to jeden z najważniejszych filarów medycyny regeneracyjnej. Są to komórki o wyjątkowych właściwościach – potrafią nie tylko przekształcać się w inne typy komórek, takie jak komórki chrząstki, mięśni czy ścięgien, ale także regulować procesy gojenia poprzez sygnały chemiczne.
Skąd pochodzą MSC?
MSC można pozyskać z kilku źródeł, najczęściej:
- ze szpiku kostnego (np. z kości biodrowej),
- z tkanki tłuszczowej (np. z brzucha lub uda),
- z krwi pępowinowej (w zastosowaniach eksperymentalnych lub bankowania).
Po pobraniu komórki są odpowiednio oczyszczane, a w niektórych przypadkach namnażane w warunkach laboratoryjnych. Następnie wstrzykuje się je w miejsce uszkodzenia tkanek.
Jak działają MSC?
Mezenchymalne komórki macierzyste nie są „łatkami”, które zastępują zniszczoną tkankę. Ich główna siła tkwi w zdolności do modulowania procesów naprawczych i wspomagania naturalnej regeneracji organizmu.
- Modulacja zapalenia – MSC potrafią „uspokajać” nadmierną reakcję układu odpornościowego, co ma kluczowe znaczenie w leczeniu urazów z towarzyszącym stanem zapalnym (np. w kolanie sportowca).
- Stymulacja angiogenezy – komórki wspomagają powstawanie nowych naczyń krwionośnych, co poprawia ukrwienie uszkodzonych tkanek i przyspiesza ich odżywienie oraz gojenie.
- Wydzielanie czynników wzrostu – MSC uwalniają tzw. cytokiny i czynniki wzrostu, które aktywują lokalne komórki do regeneracji, naprawy i odbudowy struktury tkanek.
- Różnicowanie się w inne komórki – w odpowiednich warunkach MSC mogą przekształcić się np. w komórki chrząstki (chondrocyty), mięśni (miocyty), ścięgien (tenocyty) czy tkanki kostnej (osteocyty).
Zastosowanie MSC w leczeniu urazów sportowych
Terapie komórkami macierzystymi są już z powodzeniem stosowane w leczeniu wielu kontuzji i przeciążeń typowych dla sportowców:
- Uszkodzenia ścięgna Achillesa
MSC mogą wspomóc odbudowę włókien ścięgnistych i przyspieszyć powrót do sprawności bez potrzeby długotrwałego unieruchomienia lub operacji. - Uszkodzenia chrząstki stawowej kolana
Chrząstka ma bardzo ograniczoną zdolność do regeneracji. MSC mogą pobudzać jej naprawę, a także zmniejszać stan zapalny i ból, co pomaga uniknąć zabiegu artroskopii. - Naderwania więzadeł (np. więzadła krzyżowego przedniego – ACL)
Zastosowanie MSC po urazie może zmniejszyć konieczność rekonstrukcji chirurgicznej lub skrócić okres rehabilitacji po operacji.
Dlaczego warto?
- Naturalna regeneracja tkanek, bez konieczności ich usuwania lub wymiany.
- Krótszy czas rekonwalescencji – powrót do sportu nawet o 30 – 40% szybciej.
- Małoinwazyjność – zabieg podania komórek macierzystych wykonuje się najczęściej ambulatoryjnie, pod kontrolą USG lub artroskopii.
- Mniejsze ryzyko powikłań niż w klasycznej operacji.
Bezpieczeństwo i badania kliniczne
Leczenie komórkami MSC jest uznawane za bezpieczne, o ile przeprowadzane jest zgodnie z procedurami klinicznymi i przez uprawnione ośrodki. W Polsce prowadzi się wiele badań i terapii eksperymentalnych w tym zakresie – m.in. w ośrodkach uniwersyteckich w Warszawie, Krakowie, Wrocławiu i Gdańsku.
Źródła:
Osocze bogatopłytkowe (PRP) – regeneracja z Twojej własnej krwi
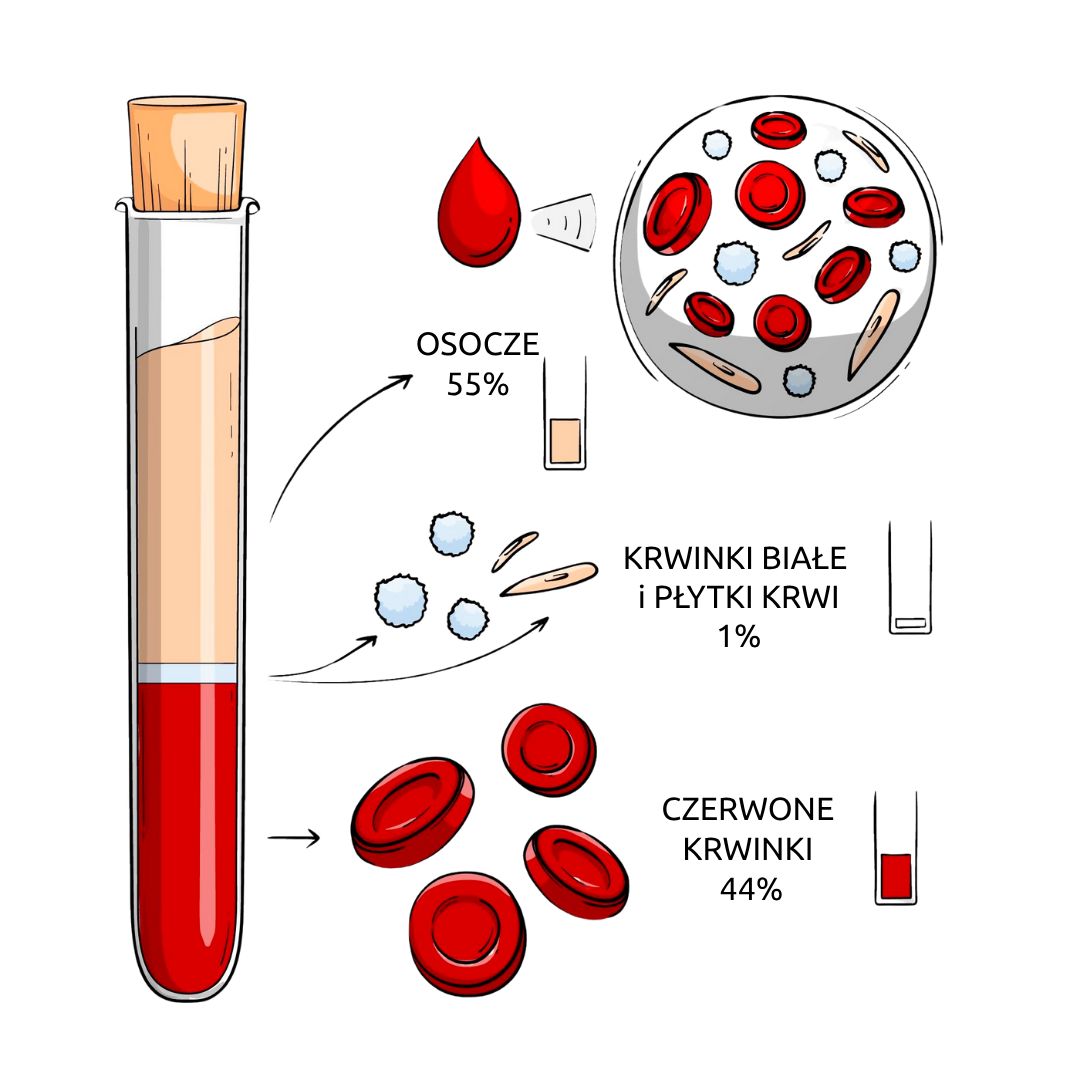
PRP (Platelet-Rich Plasma), czyli osocze bogatopłytkowe, to innowacyjna, a jednocześnie naturalna metoda wspomagania gojenia tkanek. Jest to koncentrat płytek krwi pacjenta, który zawiera dużą ilość biologicznie aktywnych czynników wzrostu, zdolnych do stymulowania procesów naprawczych i regeneracyjnych. Terapia PRP jest obecnie jedną z najczęściej stosowanych metod biologicznych w leczeniu urazów sportowych, przeciążeń oraz przewlekłych dolegliwości ścięgien i stawów.
Jak działa PRP?
Osocze bogatopłytkowe działa w sposób biologiczny, a nie mechaniczny. Nie naprawia uszkodzonych struktur „ręcznie”, ale uruchamia naturalne procesy regeneracyjne organizmu.
W PRP znajduje się nawet 5-10 razy więcej płytek krwi niż w normalnym osoczu. Po podaniu ich do miejsca urazu płytki uwalniają tzw. czynniki wzrostu, m.in.:
- PDGF – płytkopochodny czynnik wzrostu,
- TGF-β – transformujący czynnik wzrostu beta,
- VEGF – naczyniowy czynnik wzrostu śródbłonka,
- EGF – naskórkowy czynnik wzrostu.
Te substancje pobudzają namnażanie komórek, stymulują tworzenie nowych naczyń krwionośnych, zmniejszają stan zapalny oraz wspierają odbudowę kolagenu i tkanek miękkich.
Jak wygląda zabieg?
- Od pacjenta pobierana jest niewielka ilość krwi żylnej (ok. 10-60 ml).
- Krew jest odwirowywana w specjalnej wirówce laboratoryjnej, co pozwala oddzielić osocze bogate w płytki od innych składników.
- Gotowy preparat PRP wstrzykuje się bezpośrednio w miejsce uszkodzenia, często pod kontrolą USG.
Cały zabieg trwa około 30 – 40 minut, nie wymaga hospitalizacji ani długiej rekonwalescencji.
Zastosowanie PRP w sporcie i rehabilitacji
Terapia PRP jest szczególnie skuteczna w leczeniu:
- Uszkodzenia mięśni – naciągnięcia, naderwania, mikrourazy mięśni po intensywnym wysiłku,
- Terapia PRP jest szczególnie skuteczna w leczeniu:
- łokieć tenisisty,
- łokieć golfisty,
- kolano skoczka,
- ostroga piętowa.
- Uszkodzeń więzadeł i stawów – lekkie uszkodzenia ACL, urazy torebki stawowej, zmiany zwyrodnieniowe stawów.
Korzyści dla pacjenta
- Szybszy powrót do sportu – gojenie może przyspieszyć o 25–40%,
- Zabieg bezpieczny i naturalny – wykorzystuje własny materiał biologiczny pacjenta (brak ryzyka odrzutu lub alergii),
- Możliwość uniknięcia operacji – szczególnie przy przewlekłych stanach przeciążeniowych,
- Możliwość powtórzenia zabiegu – terapia może być cykliczna, w zależności od reakcji organizmu.
Bezpieczeństwo
Zabieg PRP uznawany jest za minimalnie inwazyjny i bezpieczny, szczególnie że materiał pochodzi od samego pacjenta. Ryzyko działań niepożądanych jest bardzo niskie – może wystąpić jedynie krótkotrwały ból w miejscu podania lub niewielki obrzęk. Ważne jest jednak, aby zabieg wykonywany był w profesjonalnym ośrodku medycznym, przez lekarzy przeszkolonych w terapii biologicznej.
W skrócie
Terapia PRP to skuteczna, bezpieczna i biologiczna metoda leczenia urazów. Coraz częściej stosowana przez profesjonalnych sportowców i osoby aktywne fizycznie, pomaga wrócić do sprawności szybciej, bez skalpela i bez ryzyka powikłań.
Źródła:
Implantacja chondrocytów (ACI) – naprawa chrząstki stawowej nowoczesną metodą
Autologiczna implantacja chondrocytów (ACI – Autologous Chondrocyte Implantation) to nowoczesna metoda leczenia uszkodzeń chrząstki stawowej, szczególnie w obrębie stawu kolanowego. Jej głównym celem jest odbudowa zniszczonej chrząstki przy użyciu własnych komórek pacjenta – chondrocytów, czyli komórek chrząstki.
Terapia ta jest stosowana głównie wtedy, gdy klasyczne metody leczenia (jak fizjoterapia, zastrzyki dostawowe czy artroskopia) nie przynoszą trwałej poprawy.
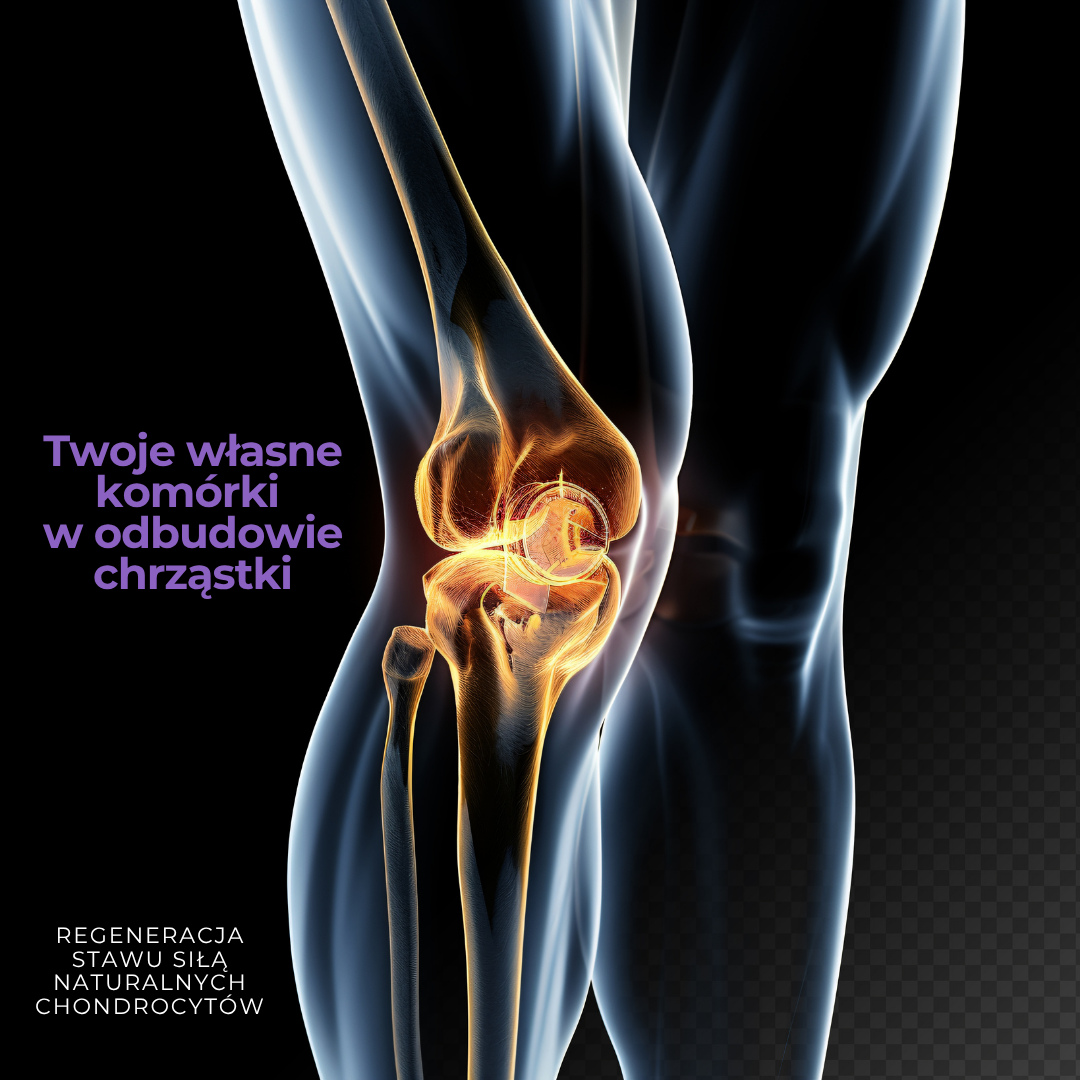
Na czym polega ACI?
Procedura ACI jest kilkuetapowa i wymaga współpracy lekarzy ortopedów, biologów komórkowych i rehabilitantów.
- Pobranie komórek chrząstki
Podczas miniartroskopii lekarz pobiera niewielki fragment zdrowej chrząstki – zwykle z miejsca, które nie przenosi dużych obciążeń (np. z bocznej strony stawu kolanowego). - Namnażanie komórek w laboratorium
Pobrane chondrocyty są izolowane i namnażane w warunkach laboratoryjnych przez ok. 4-6 tygodni. Dzięki temu uzyskuje się ich większą ilość, potrzebną do pokrycia ubytku. - Przeszczep komórek
Po namnażaniu komórki są wszczepiane do miejsca uszkodzenia. W pierwszych wersjach ACI stosowano membrany kolagenowe lub osłony z własnej błony okostnej. W nowoczesnych wersjach chondrocyty są wszczepiane razem z gotową matrycą 3D.
Dla kogo jest ACI?
Terapia ACI jest zalecana przede wszystkim dla:
- osób do 50. roku życia,
- z ograniczonym, dobrze zlokalizowanym ubytkiem chrząstki (zwykle 2–10 cm²),
- mających dobre ustawienie osi kończyny i stabilny staw,
- bez zaawansowanej choroby zwyrodnieniowej (ACI nie jest leczeniem dla osób z artrozą!).
Najczęściej stosuje się ją w uszkodzeniach chrząstki stawu kolanowego, ale również prowadzone są próby zastosowania ACI w stawie skokowym i ramiennym.
Korzyści płynące z ACI
- Odbudowa chrząstki hyalinowej (szklista) – to właśnie taki typ chrząstki naturalnie występuje w stawach i jest najbardziej pożądany. Inne terapie (np. mikrozłamania) często prowadzą do tworzenia chrząstki włóknistej, która jest mniej wytrzymała.
- Redukcja bólu – dzięki poprawie struktury stawu zmniejsza się tarcie i nacisk na uszkodzoną powierzchnię, co zmniejsza dolegliwości bólowe.
- Poprawa funkcji stawu – wielu pacjentów odzyskuje pełny zakres ruchu oraz możliwość powrotu do sportu lub aktywności zawodowej.
- Trwałość efektów – badania pokazują, że poprawa po ACI może utrzymywać się nawet przez 10–15 lat przy odpowiedniej rehabilitacji
Rehabilitacja – kluczowy element sukcesu
Po zabiegu ACI konieczna jest wielomiesięczna rehabilitacja, która obejmuje:
- odciążenie stawu (czasowo nawet do 6 tygodni),
- stopniowe zwiększanie obciążenia i zakresu ruchu,
- specjalistyczne ćwiczenia poprawiające propriocepcję i siłę mięśni.
Rehabilitacja trwa zwykle 6-12 miesięcy i jest niezbędna, aby przeszczep się przyjął i prawidłowo integrował z otaczającą tkanką.
Autologiczna implantacja chondrocytów (ACI) to zaawansowana i skuteczna forma terapii biologicznej, która pozwala na odbudowę uszkodzonej chrząstki z wykorzystaniem własnych komórek pacjenta. Choć proces leczenia wymaga czasu i zaangażowania, to w wielu przypadkach umożliwia uniknięcie endoprotezoplastyki i powrót do pełnej sprawności, również w sporcie.
Źródła:
Innowacyjne metody wspomagające – technologia w służbie regeneracji
Choć główną rolę w terapii urazów sportowych odgrywają metody biologiczne (np. PRP czy komórki macierzyste), to wspomagające terapie fizykalne i tlenoterapia hiperbaryczna odgrywają istotną rolę w przyspieszaniu procesów gojenia i poprawie komfortu pacjenta.
Współczesna medycyna sportowa korzysta z technologii, które pozwalają nie tylko na skuteczniejsze leczenie, ale również znaczne skrócenie czasu rekonwalescencji i poprawę jakości tkanek w procesie naprawy.
Tlenoterapia hiperbaryczna (HBOT)
Tlenoterapia hiperbaryczna (Hyperbaric Oxygen Therapy – HBOT) to metoda polegająca na oddychaniu czystym tlenem w warunkach podwyższonego ciśnienia (najczęściej 1,5 – 2,5 ATA) w specjalnej komorze hiperbarycznej.
Podczas zabiegu do organizmu dostarczana jest znacznie większa ilość tlenu niż w warunkach normalnych, co ma wielowymiarowe korzyści fizjologiczne.
Jak działa HBOT?
- Zwiększenie ilości rozpuszczonego tlenu w osoczu – tlen dociera nawet do tkanek o upośledzonym ukrwieniu, wspomagając ich regenerację.
- Przyspieszenie gojenia ran i mikrourazów – tlen stymuluje fibroblasty, produkcję kolagenu oraz angiogenezę (tworzenie naczyń krwionośnych).
- Redukcja stanu zapalnego i obrzęków – HBOT moduluje odpowiedź zapalną organizmu i zmniejsza przesięki płynowe w miejscu urazu.
- Efekt neuroprotekcyjny – HBOT poprawia dotlenienie mózgu i wspiera leczenie pourazowych zaburzeń neurologicznych (np. wstrząśnienia mózgu).
Zastosowanie w medycynie sportowej
- kontuzje mięśni i ścięgien,
- pooperacyjne rany i opóźnione gojenie,
- zmęczenie mięśniowe po intensywnym treningu lub zawodach,
- leczenie stanu zapalnego i obrzęków.
Bezpieczeństwo
Zabiegi są bezbolesne i nieinwazyjne. Trwają zazwyczaj od 60 do 90 minut. HBOT jest terapią zatwierdzoną przez FDA i Europejskie Towarzystwa Hiperbaryczne, również wykorzystywaną w polskich klinikach rehabilitacyjnych.
Źródła:
Terapie fizykalne: pole magnetyczne i światło LED (fotobiomodulacja)
Nowoczesne fizykoterapie wykorzystują działanie energii pola magnetycznego i światła, które w odpowiednio dobranych parametrach pobudzają regenerację komórkową i działają przeciwbólowo oraz przeciwzapalnie.
1. Pole magnetyczne niskiej częstotliwości (PEMF)
PEMF (Pulsed Electromagnetic Field) to terapia wykorzystująca zmienne pole magnetyczne o niskiej częstotliwości. Wpływa ono korzystnie na komórki i tkanki, stymulując ich aktywność metaboliczną.
Korzyści:
- poprawa mikrokrążenia,
- zmniejszenie stanu zapalnego i bólu,
- przyspieszenie gojenia kości i tkanek miękkich,
- poprawa elastyczności tkanek.
2. Fotobiomodulacja (światło LED / LLLT)
Terapia światłem LED (ang. Light Emitting Diode Therapy) lub niskoenergetycznym laserem (LLLT – Low Level Laser Therapy) to technika wykorzystująca światło czerwone i podczerwone do stymulowania procesów naprawczych na poziomie komórkowym.
Mechanizm działania wygląda następująco:
- światło przenika do głębszych warstw skóry i mięśni,
- pobudza mitochondria do produkcji ATP (energii),
- redukuje stres oksydacyjny,
- aktywuje procesy przeciwzapalne.
Zastosowanie:
- terapia bólu mięśni i stawów,
- leczenie urazów skóry i tkanek miękkich,
- przyspieszanie regeneracji po kontuzjach i operacjach.
Zarówno tlenoterapia hiperbaryczna, jak i terapie fizykalne z użyciem pola magnetycznego i światła LED to skuteczne i bezpieczne metody wspomagające proces regeneracji w sporcie. Ich rola polega nie tylko na łagodzeniu objawów, ale przede wszystkim na przyspieszeniu biologicznej odbudowy tkanek, co w połączeniu z terapiami komórkowymi lub PRP pozwala osiągnąć lepsze, szybsze i trwalsze efekty leczenia.
Dlaczego to ważne?
Medycyna regeneracyjna zmienia zasady gry – dosłownie i w przenośni. Dzięki nowoczesnym terapiom możliwe jest nie tylko szybsze leczenie kontuzji, ale także ograniczenie ryzyka ich nawrotu. Regeneracja przebiega sprawniej – czas powrotu do aktywności może skrócić się nawet o 30–50%, co jest kluczowe dla sportowców, dla których każdy dzień poza treningiem to strata. Co więcej, wiele metod pozwala uniknąć operacji, a tym samym hospitalizacji i potencjalnych powikłań. To szansa na zachowanie ciągłości kariery, bezpieczeństwo zdrowotne i szybszy powrót do pełnej sprawności – bez przerywania sportowej drogi.
Czas to największa wartość sportowca
Nowoczesne terapie regeneracyjne dają sportowcom to, czego potrzebują najbardziej – czas. Czas, by wrócić do gry. Czas, by nie przerywać kariery z powodu urazu. Czas, by zdrowie nie było przeszkodą, ale wsparciem w osiąganiu kolejnych celów.
Źródła:




